在当前生物药物靶点研究领域中,IL-4与IL-13作为T辅助细胞2型(Th2)细胞因子家族的核心成员,正逐步走到台前,成为众多炎性疾病和自身免疫病治疗的新突破口。
近岸蛋白推出人源、鼠源、猴源及多标签的IL-4、IL-4RA、IL-13、IL-13RA1/L-13RA2 靶点蛋白,专为抗体药物早期开发的免疫与筛选环节设计。我们的靶点抗原经过严格活性验证,并搭配参考抗体及稳转细胞株,助力科研人员高效构建高亲和力、高特异性的抗体药物。此外,公司提供从抗体发现、表达纯化到功能验证的一站式服务,全面赋能IL-4/IL-13通路药物研发,加速您的研发进程。
靶点综述 炎症与免疫调控中的关键角色
IL-4与IL-13不仅是过敏性炎症的重要调节因子,还在类风湿性关节炎(RA)、系统性红斑狼疮(SLE)、银屑病关节炎(PsA)等自身免疫疾病中发挥关键作用[1]。研究发现,这两种细胞因子能够下调多种促炎细胞因子的表达,包括IL-1、IL-6、TNF-α等[2],并抑制Th17细胞的分化及其促炎因子的释放,从而在调控免疫平衡、缓解病理性炎症反应中发挥抗炎作用[3]。
随着对IL-4/IL-13通路在免疫调节中的作用机制的深入认识,多个靶向该通路的抗体类药物相继进入市场或临床开发阶段。这些药物主要用于治疗以Th2型免疫反应异常为核心机制的疾病,涵盖过敏性疾病(如哮喘、特应性皮炎)及部分自身免疫性疾病。
市场前沿 IL-4/IL-13通路药物研发进展
目前,全球多个靶向IL-4/IL-13通路的抗体药物已进入临床或实现商业化。早在2017年,赛诺菲与再生元联合开发的IL-4Rα单抗度普利尤单抗(Dupilumab)获批上市,2024年销售额突破140亿美元。国内方面,康诺亚的司普奇拜单抗于2024年获批上市,成为第一个国产IL-4Rα抗体药物;齐鲁制药的QL2108已进入III期临床。其他如辉瑞(PF-07275315)和北京伟德杰等公司也在积极推进相关靶点布局,充分验证了IL-4/IL-13通路的临床价值与市场前景。
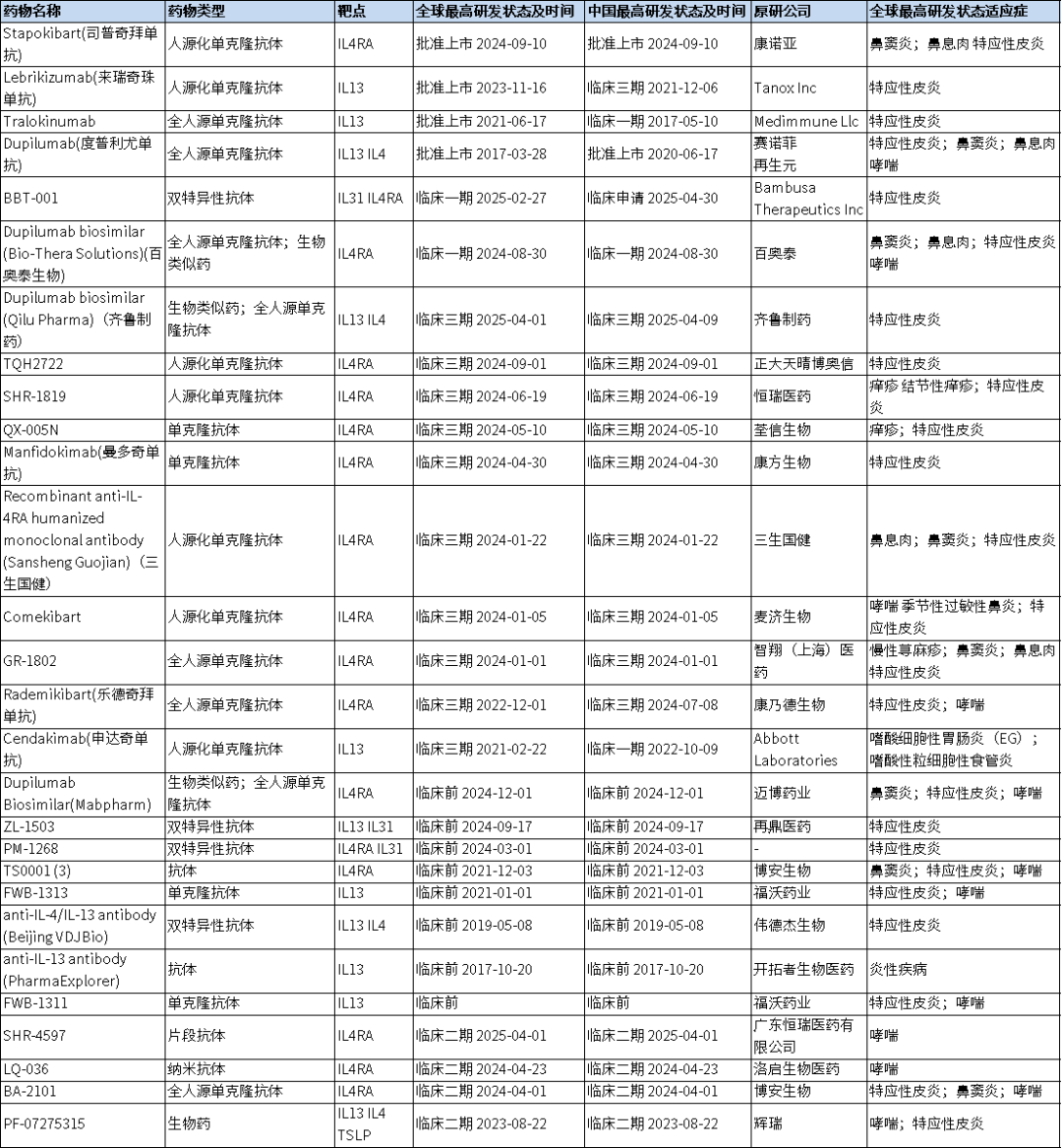
图1. IL-4/IL-4RA/IL-13/IL13RA靶点药物临床进展
(来源药渡数据)
核心因子解析 IL-4与IL-13的结构与功能
01 IL-4:早期发现,功能多样的免疫调节因子
IL-4最早于1982年被发现,具有诱导小鼠B细胞增殖的能力,其人源IL-4基因位于染色体5q31,与IL-13、IL-3、IL-5、IL-9等Th2相关因子基因簇相邻[4]。IL-4的结构为四螺旋束(four-helixbundle),含有三个二硫键,其成熟蛋白分子量为约15.4kD[5]。功能上,IL-4不仅可促进B细胞增殖,还能刺激IgE和IgG4的免疫球蛋白类别转换[6],活化嗜酸性粒细胞、肥大细胞和嗜碱性粒细胞,并诱导Th2细胞的分化。此外,它还能诱导成纤维细胞产生胶原,促进血管内皮细胞表达粘附分子(VCAM-1),参与组织修复与重塑[7]。
02 IL-13:结构相似,功能互补的“搭档”
IL-13于1983年首次在小鼠活化Th2细胞中被发现,1993年克隆出人源基因。它同样是一种四螺旋束细胞因子,在结构上与IL-4有25%的氨基酸序列相似度,功能上也有部分重叠。IL-13具有诱导粘液分泌、杯状细胞化生和平滑肌细胞收缩的作用,这些机制在气道重塑过程中尤为重要。此外,它也能刺激成纤维细胞合成胶原,促进慢性炎症中的组织纤维化进程[8]。同IL-4一样,IL-13也能抑制多种促炎因子和趋化因子的表达,如IL-8、MCP-3、IP-10、MIP-3等,同时调控巨噬细胞向抗炎表型极化(M2型)[9]。这些作用使其在自身免疫性疾病、如银屑病、I型糖尿病、实验性自身免疫性脑脊髓炎(EAE)等动物模型中展现出潜在的治疗价值。
信号通路机制 共用受体下的多元调控
IL-4与IL-13的生物活性主要通过与各自的受体结合后激活下游信号通路来实现。它们共享一个二型受体(type II receptor),该受体由IL-4Rα与IL-13Rα1两个亚基组成,能够结合IL-4或IL-13发挥信号传导功能。此外IL-4还可以与I型受体(type I receptor)结合,该受体由IL-4Rα与通用γ链(γC)组成,仅IL-4可识别。IL-13也能结合IL-13Rα2,该受体被认为是一个“诱饵”受体,不参与经典信号通路。当IL-4或IL-13与其受体结合后,会激活Janus激酶家族(JAK1,JAK2,JAK3),继而磷酸化信号转导与转录激活因子STAT6,使其转位入核,调控多种免疫稳态维持与炎症抑制相关的基因。此外,还可能激活STAT3、PI3K以及MAPK等其他信号通路,调节更广泛的细胞功能[1]。
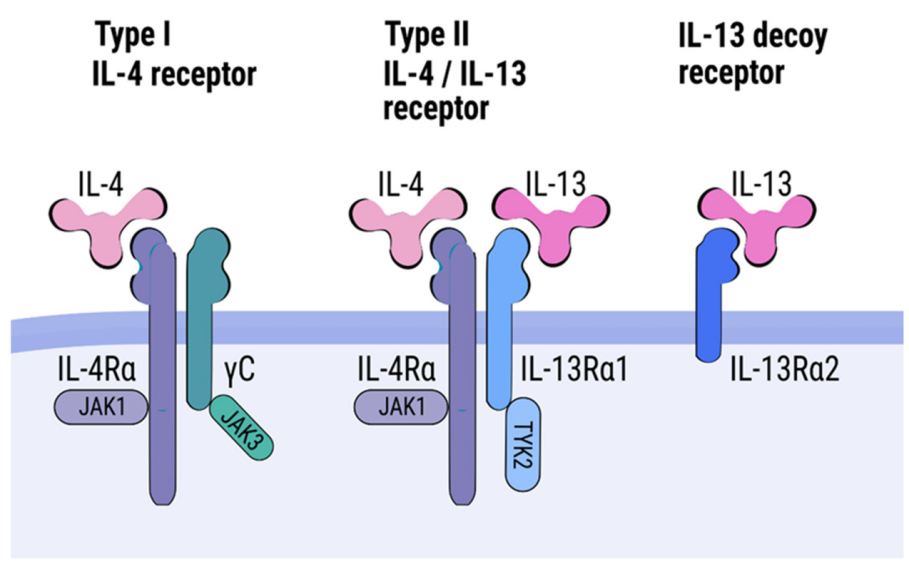
图2. IL-4与IL-13的受体机制[1]
部分数据展示
经过SEC-HPLC验证
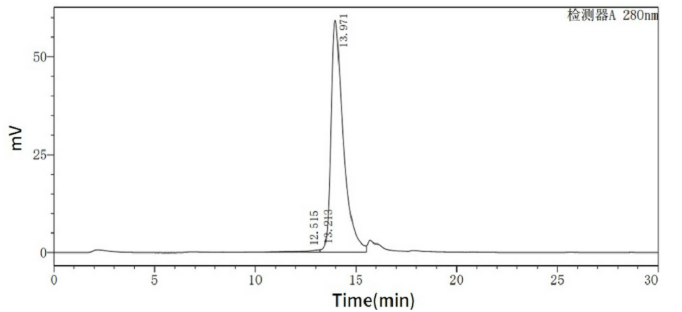
Greater than 95% as determined by SEC-HPLC.(QC verified)
经过ELISA验证
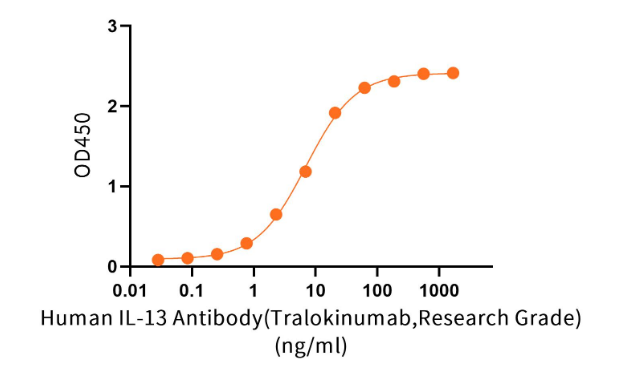
Immobilized Recombinant Cynomolgus IL-13 (C-6His)(Cat.No.:C37G) at 1 μl/ml (100 μl/well) can bind Anti-Human IL-13 Antibody (TRA_bio,Research Grade)(Cat.No.:NC359).The ED50 of Anti-Human IL-13 Antibody (TRA_bio,Research Grade)(Cat.No.:NC359) is 7.05 ng/ml.(Regularly tested).
经过批间稳定性验证
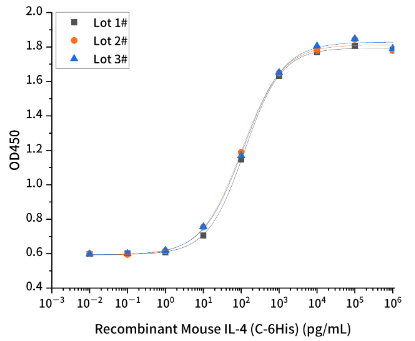
Measured in a cell proliferation assay using M-NFS-60 mouse lymphoblast cells.Three independent lots were tested for activity and plotted on the same graph to show lot-to-lot consistency of IL-4.
经过Cell Based Assay验证
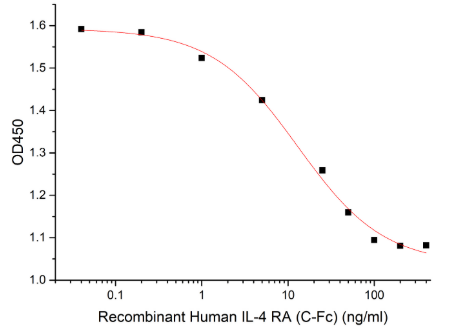
Measured by its ability to inhibit IL-4-dependent proliferation of TF‑1 human erythroleukemic cells.The ED50 for this effect is 5-20 ng/ml. (QC verified)
经过BLI验证
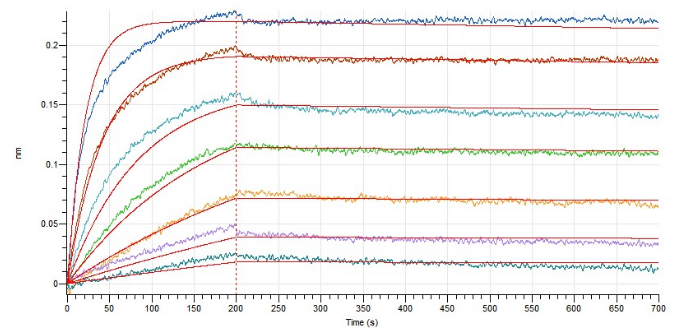
Loaded Human IL-4-His(Cat.No.:CX88) on HIS1K Biosensor, can bind Human IL-4RA-Fc(Cat.No.:CS38) with an affinity constant of 0.12 nM as determined in BLI assay.
相关产品
| Cat.No. | Product Name | Tag |
| CX88 | Recombinant Human IL-4 | C-6His |
| CK74 | Recombinant Mouse IL-4 | C-6His |
| GMP-CD03 | Recombinant Human IL-4 | Tag Free |
| CC89 | Recombinant Human IL-13 | C-6His |
| C37G | Recombinant Cynomolgus IL-13 | C-6His |
| CX56 | Recombinant Mouse IL-13 (110AA) | C-6His |
| CS32 | Recombinant Human IL-13RA1 | C-6His |
| CB12 | Recombinant Mouse IL-13RA1 | C-Fc |
| C38U | Recombinant Human IL-13RA2 | C-Fc |
| C43H | Recombinant Mouse IL-13RA2 | C-Fc |
| CS38 | Recombinant Human IL-4 RA | C-Fc |
| CB94 | Recombinant Human IL-4 RA | C-mFc |
| CS33 | Recombinant Human IL-4 RA | C-6His |
| C939 | Recombinant Cynomolgus IL-4RA | C-Fc |
| C938 | Recombinant Cynomolgus IL-4RA | C-6His |
| CB03 | Recombinant Mouse IL-4RA | C-Fc |
| C08R | Recombinant Mouse IL-4RA | C-6His |
| CY142 | Biotinylated Human IL-4RA | C-Avi-6His |
| CY141 | Biotinylated Human IL-4 | C-6His-Avi |
| CB13 | Biotinylated Mouse IL-13RA1 | C-Avi-6His |
| NC359 | Anti-Human IL-13 Antibody (TRA_bio, Research Grade) | - |
| NC232 | Anti-Human IL-4RA Antibody (DUP_bio, Research Grade) | - |
参考文献
[1] Bogunia-Kubik K. Significance of Interleukin (IL)-4 and IL-13 in Inflammatory Arthritis[J].Cells, 10(11):3000[2025-05-22].DOI:10.3390/cells10113000.
[2] Hershey G K K. Hershey, GK. IL-13 receptors and signaling pathways: an evolving web. J Allergy Clin Immunol 111: 677-690; quiz 691[J].Journal of Allergy and Clinical Immunology, 2003, 111(4):677-90; quiz 691.DOI:10.1067/mai.2003.1333.
[3] D,C,Newcomb, et al. A Functional IL-13 Receptor Is Expressed on Polarized Murine CD4+ Th17 Cells and IL-13 Signaling Attenuates Th17 Cytokine Production[J].The Journal of Immunology, 2009, 182(9).DOI:10.4049/jimmunol.0803868.
[4] Howard, M. Identification of a T cell-derived b cell growth factor distinct from interleukin 2.[J].Journal of Experimental Medicine, 1982, 155(3):914-923.DOI:10.1084/jem.155.3.914.
[5] Walter M R, Cook W J, Zhao B G, et al. Crystal structure of recombinant human interleukin-4[J].Journal of Biological Chemistry, 1992, 267(28):20371-20376.DOI:10.2210/pdb2int/pdb.
[6] Nandayapa M. Prendas de un idioma crepuscular: versión original del prefacio de Atalazor de Vicente Huidobro[J].Journal of Experimental Medicine, 2006, 173(3):747-50.DOI:10.1084/jem.173.3.747.
[7] Harakati M S E. Pernicious Anemia in Arabs[J].Blood Cells Molecules & Diseases, 1996, 22(2):98.DOI:10.1006/bcmd.1996.0015.
[8] Endo T A, Masuhara M, Yokouchi M, et al. A new protein containing an SH2 domain that inhibits JAK kinases.[J].Nature, 1997, 387(6636):921-924.DOI:10.1038/43213.
[9] Funes, Samanta, C, et al. Implications of macrophage polarization in autoimmunity[J].
Immunology An Official Journal of the British Society for Immunology, 2018.
